현장 진료: 출혈성 쇼크에서 응고 장애의 평가
Point of Care: Assessment of Coagulopathy in Hemorrhagic Shock
Article information
Abstract
Traumatic bleeding is a prime cause of mortality after trauma, responsible for 40% of trauma- related early death. Traumatic bleeding often occurs as direct bleeding from injured site and is frequently complicated by trauma-induced coagulopathy (TIC). Traditionally, TIC was related to hemodilution, coagulation factor consumption, acidosis and hypothermia. However, TIC is now considered shock-associated hypoperfusion, a combination that activates the protein C pathway. While this adds to the understanding of this condition, the pathophysiology of TIC is not fully understood. Because TIC is composed of multiple factors, point-of-care testing (POCT) of coagulopathy that can rapidly provide information on an individual patient’s coagulation status is important. Among POCT tests are viscoelastic tests (VET), of which the most commonly used are thromboelastography and thromboelastometry. These provide rapid and dynamic bedside assessment of TIC. Treatment algorithms using VET results reduce mortality, morbidity and amount of transfusion. Although VET offers several advantages, there are limitations. VET cannot reduce mortality and morbidity, cannot fully assess the entire coagulation process, need ongoing quality control protocols, and require trained personnel. In conclusion, despite its limitations, VET has many advantages in assessment of TIC, POCT and treatment of TIC. Efforts to overcome the limitations are needed.
서론
출혈은 외상으로 인한 사망 원인의 절반을 차지한다[1]. 따라서 외상으로 인한 사망을 줄이기 위해서는 출혈을 조기에 적절하게 치료하는 것이 중요하다. 출혈의 원인은 손상 부위에서의 직접 출혈뿐만 아니라 외상으로 인한 응고 장애에 의해 발생되는 이차적인 출혈에 의해서도 발생된다. 그러므로 일차적으로 출혈 병소를 조절하고, 응고 장애에 의한 이차적인 출혈을 예방하며, 치료하기 위해 응고 체계의 평가는 외상성 출혈 환자에서 매우 중요하다.
외상 후 응고 장애의 정확한 기전은 아직 명확하지 않다. 전통적으로 외상으로 인한 출혈성 쇼크에서 발생되는 응고 장애는 수액 공급에 따른 혈액 희석, 응고 인자 소진, 산혈증, 저체온증에 의한 이차적인 현상으로 인식되었다[2]. 그러나 최근 이러한 응고 장애는 응고 인자의 이상 기능보다는 C protein pathway의 활성화로 인한 항응고인자의 활성화, 섬유소 과분해에 의한 것이라는 주장이 제기되었다[3,4]. 뿐만 아니라 조직 손상, 조직 저산소화, 응고 인자 희석, 저칼슘혈증, 저체온증, 대사성 산증, 염증 등의 원인도 복합적으로 작용하고 있다는 주장도 제기되었다[5]. 따라서 외상에 의한 출혈성 쇼크의 효율적인 치료를 위해 응고 체계를 이해하고, 이러한 응고 체계를 적절하게 평가할 수 있는 검사들에 대해 외과 의사가 이해하는 것은 매우 중요하다.
이러한 외상성 응고 장애를 평가할 수 있는 검사로 전통적인 응고 검사뿐만 아니라 현장 진단용 검사로 점성 탄성 검사가 대두되어 이러한 검사들에 대해 논의해보고자 한다.
본론
전통적인 혈액 응고 검사
일반적인 초기 혈액학적 검사는 prothrombin time (PT), international normalized ratio (INR), activated partial thromboplastin time (aPTT), platelet count 등의 검사이다.
PT 검사는 plasma에 calcium과 thromboplastin을 첨가하여 fibrin clot을 형성을 유도한다. PT 검사는 I, II, V, VII, X 인자의 기능을 측정하며, vitamin K 결핍에 의한 응고장애를 진단하는 데 많은 도움을 준다[6]. 그러나 thromboplastin의 역할에 변화가 많아서 PT 단독보다는 INR을 함께 보고하는 방법을 채택하고 있으며 계산식을 통해 산출된다[6]. aPTT는 phospholipid substrate activator와 calcium을 첨가하여 측정된다. aPTT는 I, II, V, VIII, IX, X, XII의 기능을 측정하는 것으로 heparin 치료를 감시하는 검사로 자주 사용된다[6]. Bleeding time은 platelet과 혈관의 기능 이상을 측정하는 검사이다. 그러나 많은 변수의 영향을 받기 때문에 출혈성 질환 환자를 평가하는 데 도움이 되지만 술 전 정상 환자를 평가하는 기능으로는 거의 사용되지 않는다[7].
이러한 전통적인 검사는 혈액 세포들 간의 작용을 고려하지 않은 혈장에 기초한 검사들로, 복합적인 혈액 응고의 전반적인 반응을 나타내기보다는 각 인자들의 단편적인 상태만을 나타내며 결과 또한 특이성이 부족하였다[8]. 따라서 전통적인 혈액 응고 체계는 혈액 응고 인자 결핍증 등의 진단과 항응고제 사용에 따른 감시에는 효율적이나 외상에 의한 출혈성 쇼크와 그에 따른 복잡한 응고 장애를 진단하거나 치료하는 데에는 한계가 있다. 또한 결과를 확인하는 데 시간이 오래 소요되어 즉각적인 치료 시행의 지표로 삼기에는 부적절하였다[9]. 기타 protein C, thrombomoduline, euglobuline time, plasmin-antiplasmin complex, PAI-1, thrombin activatable fibrinolysis inhibitor, D-dimers 등의 검사도 비용이 비싸고, 시간이 오래 걸린다. 이러한 여러 가지 제한점으로 전통적인 혈액 응고 검사는 출혈 환자에서 응고 장애를 감시하고 수혈의 지침으로 삼기에는 부적절하다[10,11].
점탄성 검사(viscoelastic test)
전통적인 혈액 응고 검사는 혈액의 세포 성분을 제외한 혈장을 기초로 하였으나 최근에는 혈장뿐만 아니라 혈액 내 세포 간의 상호 작용에 근거한 응고체계가 중요하다고 알려졌다[12].
이러한 세포 간의 상호 작용에 근거한 응고 체계를 검사할 수 있는 검사로 점탄성 검사가 있다. 점탄성 검사는 혈액 응고의 연쇄 반응에 혈전의 생성에서부터 용해까지의 복잡하고 역동적인 과정을 전반적으로 그래프로 나타낼 수 있으며, 혈전의 생성과 용해의 정도를 판별할 수 있는 검사 방법으로 알려졌다[8,13]. 또한 기존의 전통적인 응고 검사들은 검체를 채취하여 결과가 나오기까지 1∼2시간 정도 소요되었으나, 점탄성 검사는 대부분의 지표들의 결과값이 10분 이내에 측정되므로 외상성 출혈 환자에서 즉각적인 혈액 응고 장애 상태를 파악할 수 있는 장점이 있다. 이러한 장점들로 현장 검사 측면에서 기존의 응고 검사에 비해 우월성을 가지고 있다.
이에 최근에는 출혈이 지속되는 환자에서 복잡하게 급변하는 인체 내의 응고체계를 평가하는 점탄성 검사로 thromboelastography (TEG; Haemoscope-Haemonetics, Niles, IL, USA)와 rotational thromboelastometry (TEM; Tem Systems Inc., Durham, NC, USA)가 있다. 두 가지 검사는 검사 원리와 검사에 따른 지표들의 항목도 거의 유사하다. 그러나 지표들의 불리는 명칭이 서로 다르며 점탄성 검사의 특성상 여러 종류의 activator와 inhibitor를 사용하기 때문에 첨가제에 따라 검사의 기준치가 다르고 검사 방법도 조금씩 다르다. 따라서 이번 종설에서는 TEG의 경우를 들어 주로 기술하겠다.
TEG는 1948년 Hartert [14]에 의해 처음 소개되었다. 그러나 과거에는 이러한 점탄성 검사가 외과 영역에서 외과 의사들에게 익숙하지 않다는 이유로 많이 이용되지는 않았다[15,16]. 그러나 최근 들어 많은 외상 센터에서 전통적인 혈액 응고 검사의 단점을 극복하고자 외상 후 응고 장애를 진단하고 치료하는 데 기본적인 검사로 대두되었다[12].
TEG는 37도로 가온된 컵과 torsion wire에 달려 있는 핀, 두 가지 부분으로 나뉘어져 있다. 과거에는 컵을 가온하는 데 30분 정도의 시간이 소요되었으나 지속적으로 개선되어 최근 출시되는 기계는 컵이 가온되는 데 시간이 소요되지 않는다. 혈액 검체는 주사기로 검체를 채취하여 citrate가 포함된 용기에 담을 수 있으며, 항응고제가 포함되지 않은 용기에 담을 수도 있다. Citrate가 포함된 용기에 검체를 담은 경우에는 10∼120분 안에 검사를 실시해야 하며, 항응고제가 포함되지 않은 상태에서는 실온에 보관 시 4∼6분 안에 검사를 실시해야 한다. Rapid TEG의 경우에, 카올린 바이알의 캡을 열고 피펫을 이용해 카올린 바이알에 1.0 ml의 혈액을 옮겨 넣은 후 옆면으로 흘러내리게 둔다. 캡을 원위치하여 바이알을 밀폐시키고, 서서히 거꾸로 뒤집어 주는 것을 5회 반복하여 섞어 준다. 이때, 절대 검체를 흔들어서는 안된다. 항응고제 처리가 되지 않은 경우에는 0.36 ml를 피펫을 이용해 TEG 분석기의 컵 안에 넣는다. Citrate 처리가 된 혈액 검체의 경우에는 0.34 ml를 피펫으로 채취해 0.2 M 염화칼슘 0.02 ml가 담겨진 컵에 넣어 TEG 검사를 시행한다. 컵을 핀이 작동하는 곳으로 올려주면 자동으로 검사가 이뤄진다.
컵은 양 방향으로 각각 4.5초 동안 4.45도 기울어져 회전을 하게 되는데, 1회 회전할 때 1초의 정지 시간을 포함하여 10초가 소요되며 그래프는 2 mm/min의 속도로 기록된다. 혈전의 형성 정도에 따라 핀도 컵과 같이 회전을 하게 되며 이때 점성 탄력성(viscoelasticity)에 의해 발생되는 회전력이 torsion wire에 전달되어 TEG의 그래프를 그리게 되는 것이다. 혈전이 형성되지 않을 경우에는 TEG는 직선의 그래프로 나타나게 된다[17].
앞서 기술한 대로 TEG와 TEM에서는 여러 가지 활성제와 억제제를 첨가하여 다앙한 임상 상황에서의 응고 상태를 평가할 수 있다. 기존 TEG에서 koalin과 tissue factor를 첨가하면 r-TEG라고 하여 첨가하지 않았을 때보다 검사 시간이 50% 빨라져 더욱 신속하게 결과를 알 수 있다. 또한 heparinase를 첨가하면 heparin 치료를 받는 환자에서 heparin에 의한 항응고 효과를 배제한 응고 결과를 알 수 있다. 이러한 활성제와 억제제의 첨가는 TEM에서도 마찬가지로 적용되어 다양한 임상 상황에서의 응고 장애에 대한 평가를 측정할 수 있다[18].
점탄성 검사의 지표
TEG에서는 통상적으로 reaction time (r time), K time, α angle, maximum amplitude (MA), Ly30 등의 값이 산출된다. 다른 점탄성 검사인 TEM에서는 r time에 해당되는 지표로 clotting time, K time은 clot formation time, MA는 maximum clot firmness 등의 명칭으로 불린다(Table 1) [18,19].
TEG 검사에서 나타나는 그래프에서 대락적인 지표의 위치는 Fig. 1과 같다. r time은 검사가 시작되고 혈전이 형성되기 시작할 때까지의 시간을 의미한다. 그래프의 amplitude가 2 mm에 이르는 시간을 나타내며, 응고 인자의 활동성과 초기 섬유소 형성을 반영한다. 기준치보다 증가된 r 값은 저응고 상태로 진단할 수 있다. 반면 감소된 r 값은 과응고 상태로 심부정맥혈전증이나 폐혈전증의 위험성을 나타내기도 하고, 심부정맥혈전증의 예방적 치료의 필요성을 나타내기도 한다[12].
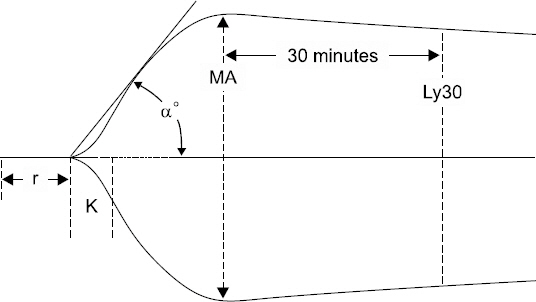
Typical graph of thromboelastography. MA: maximum amplitude, r: reaction time, K: clot formation time.
K time은 r time에서부터 amplitude가 20 mm에 이르는 시간을 나타낸다. K time은 혈전이 견고해지는 속도를 의미하고 응고인자와 혈소판 간의 상호작용을 반영한다[17]. α angle은 r time에서부터 K time의 amplitude가 20 mm까지 연결한 직선의 기울기를 말하는 것으로 K time과 같이 혈전의 견고해지는 속도를 의미한다. 이들 K time과 α angle은 fibrinogen이 fibrin으로 바뀔 때 thrombin의 부착을 대변한다. 이 값들이 기준치보다 증가할 때는 저섬유소증이나 혈소판 기능 이상을 나타낸다[12].
MA는 그래프에서 가장 큰 amplitude를 나타낸다. 이 값은 응고된 혈전이 가장 견고한 상태를 말한다[17]. 이 값이 기준치보다 낮을 때는 혈소판, 섬유소원의 기능 이상이나 결핍을 의미한다.
마지막으로 lysis time이 있으며, 이는 MA에서 일정 시간이 흐른 뒤 섬유소 용해의 정도를 나타내는 값으로 5분, 30분, 60분 등으로 다양하다. 특히 estimated percent lysis로 불리는 값은 MA에서 5분 경과하였을 때의 fibrinolysis의 값을 나타낸다. 이러한 %값은 기준치 MA로부터의 감소된 amplitude의 %값으로 나타내지며 이 값이 기준치보다 증가되었을 때에는 fibrinolysis가 항진되었음을 의미한다.
점탄성 검사의 활용과 연구 동향
점탄성 검사를 통한 연구는 최근 지속적으로 보고되고 있다. 최근에는 이렇게 측정된 결과를 통해 외상성 출혈 환자에서 성분 수혈 선택과 수혈 양을 결정하거나 예측하는 지침으로 이용할 수 있으며 대량 수혈을 시행할 때의 지침으로도 도움이 된다고 하였다[5,12,20]. 그러나 TEG 검사 결과를 바탕으로 하는 성분 수혈의 지침은 기관마다 조금씩 다르다[21].
기존의 전통적인 혈액 응고 검사를 기본으로 하는 수혈 지침보다 점탄성 검사를 기준으로 수혈하였을 때 수혈량을 줄일 수 있다는 보고들도 있다[22]. 또한, 외상 환자에서 사망을 예측하는 독립적인 인자라는 보고도 있다[23,24].
무작위 임상 연구에서 점탄성 검사를 지침으로 하는 수혈은 수혈량을 감소시키기는 하지만 사망과 합병증을 감소시키지는 않았다고 하였다[25]. 그러나 최근 심장 수술 환자의 무작위 임상 연구에서는 수혈 요구량과 사망의 감소를 보였다는 보고도 있다[26].
점탄성 검사의 제한점 및 한계
점탄성 검사의 장점에도 불구하고 점탄성 검사는 몇 가지 제한점을 가지고 있다. 전통적인 응고 검사보다는 전반적인 응고 체계를 검사할 수 있는 방법이지만 여전히 혈관 내벽의 영향을 포함한 전체 응고 체계를 완전히 평가할 수는 없다. 또한 응고 과정을 인위적으로 조성하여 측정하였다는 단점이 있다. 또한 검사 과정에서 핀이 인위적으로 회전하는데 이러한 핀의 인위적인 회전으로 인해 소실되는 응고 인자에 대한 고려가 없다. 앞서 기술한 대로 점탄성 검사를 하면서 첨가되는 활성제나 억제제가 결과에 오류를 가져올 수 있다. 외상성 출혈 환자에서 즉각적인 응고 장애와 성분 수혈의 종류, 양을 결정하기 위해 현자 검사로 이용될 수 있으나 이로 인해 현장에서 검사를 시행함에 있어 실험실 경험이 부족한 의사나 기타 인력이 검사를 시행할 가능성이 높아서 이로 인한 검사 결과의 신뢰도, 검사 기계의 질관리, 의료 인력의 기계 작동 기술의 숙련도에 대한 문제가 존재한다[16]. 그리고 이러한 검사 기계를 잘 작동할 수 있도록 하는 훈련, 프로토콜, 검사의 표준화가 필요하다[18].
결론
전통적인 혈액 응고 검사에 비해 TEG와 TEM과 같은 점탄성 검사들은 외상 환자에서 변화하는 혈액 응고 과정을 역동적으로 나타낸다. 또한 점탄성 검사들로 알 수 있는 지표들은 기존의 혈액 응고 검사보다 신속하게 결과값이 산출되므로 외상성 출혈 환자에서 즉각적인 조치를 취하는 데 도움을 준다. 그러나 점탄성 검사에 기초한 수혈 지침 등이 기관마다 조금씩 다르고 현장 검사로서 질관리의 문제와 검사를 시행할 의료 인력의 기계 작동에 대한 미숙함 등의 제한점은 여전히 극복해야 할 과제로 생각된다.
